กรณีถังเก็บสารสไตรีนระเบิด
แม้ว่ากรณีไฟไหม้ที่โรงงานหมิงตี้ยังไม่มีข้อสรุปถึงสาเหตุของการเกิดระเบิด แต่สำหรับกรณีเหตุระเบิดบริเวณถังเก็บสารสไตรีนโมโนเมอร์ (หรือสไตรีน) บนเรือ Stolt Groenland (2019) ได้มีรายงานสอบสวนอุบัติเหตุออกมาเมื่อเร็วๆนี้ โดยระบุสาเหตุของการเกิดระเบิดมาจากการเกิดปฏิกิริยาพอลิเมอไรเซชั่นของสารสไตรีน (self-polymerization) ในถังเก็บ [1] ซึ่งปฏิกิริยานี้มีการคายความร้อนสูง (71 kJ/mol หรือ 681 kJ/kg) เมื่อสารสไตรีนที่เหลือได้รับความร้อนจนมีอุณหภูมิสูงขึ้น จะยิ่งเร่งปฏิกิริยาให้เกิดเร็วขึ้นเรื่อยๆจนนำไปสู่การเกิดระเบิด (auto-accelerate thermal runaway)

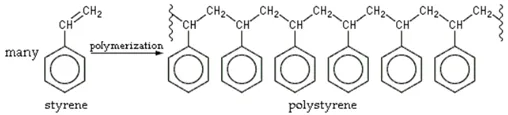
ปฏิกิริยาพอลิเมอไรเซชันของสารสไตรีนเป็นแบบเติม (addition polymerization) คือการที่สไตรีนโมโนเมอร์มาเรียงต่อกันแบบในรูปที่ 2 ในการผลิตพอลิเมอร์ของสไตรีนในเชิงอุตสาหกรรมนิยมใช้กลไกในการเกิดปฏิกิริยาแบบ free radicals โดยมีสาร benzoyl peroxide เป็นสารเริ่มปฏิกิริยา (initiator) [3]
แต่ในสภาวะที่ไม่มีสารเริ่มปฏิกิริยา (เช่นในถังเก็บ) สารสไตรีนก็สามารถสร้าง free radicals ผ่านการทำปฏิกิริยา Diels-Alder (ปฏิกิริยาระหว่างสารประกอบ Diene กับสารที่มีพันธะคู่ไม่อิ่มตัว) กับตัวมันเองได้เมื่ออุณหภูมิสูงขึ้นถึงจุดหนึ่ง ในทางปฏิบัติเพื่อป้องกันอันตรายจาก thermal runaway ในถังเก็บสารสไตรีน จะทำการรักษาอุณหภูมิให้อยู่ต่ำกว่า 20-30°C และจะมีการเติมสารหน่วงปฏิกิริยา (Inhibitor) ลงไปผสมเพื่อลดความว่องไวของสไตรีน
ในเหตุระเบิดบนเรือที่มีถังเก็บสไตรีน พบว่าปริมาณสาร Inhibitor มีอยู่ในปริมาณที่มากเพียงพอ และชี้ประเด็นว่าการดูแลเก็บรักษาสารสไตรีนที่ไม่เหมาะสมนั้นนำไปสู่การเกิดปฏิกิริยาและเกิดระเบิดในที่สุด จากการวิเคราะห์บันทึกค่าอุณหภูมิในถังเก็บสไตรีนพบว่า ค่าของอุณหภูมิเพิ่มขึ้นเรื่อยๆจากค่าควบคุมที่ 30°C เป็นเวลาหลายวันก่อนการเกิดระเบิด โดยเพิ่มจาก 50°C (3 วันก่อนเกิดเหตุ) เป็น 65°C (1 วันก่อนเกิดเหตุ) จนถึง 90°C ในช่วงก่อนเกิดการระเบิดขึ้น — ถ้าลองสังเกตุการเพิ่มขึ้นของอุณหภูมิจะประเมินได้ว่าความเร็วในการเกิดปฏิกิริยาจะเพิ่มขึ้นสูงในวันท้ายๆ (จาก Van’t Hoff rule – อัตราเร็วในการเกิดปฏิกิริยาจะเพิ่มขึ้น 2 เท่าทุกๆอุณหภูมิที่เพิ่มขึ้น 10°C) —
อุบัติเหตุจาก polymerization runaway นั้นเกิดขึ้นค่อนข้างบ่อยในอุตสาหกรรมโดยคิดเป็นประมาณ 15% ของ reactive chemical incidents โดยสารที่สามารถเกิดเหตุอันตรายจากปฏิกิริยาที่สามารถเร่งตัวเองได้ ในลักษณะเดียวกับกรณีของสารสไตรีนโมโนเมอร์ ได้แก่ Butadiene, Ethylene oxide, Hydrogen cyanide, Vinyl acetate, Propyleneimine เป็นต้น
นอกจากนี้ การประเมินอันตรายของปฏิกิริยาในลักษณะนี้ยังมีความซับซ้อนอีกด้วย ตัวอย่างด้านล่างจะเป็นกรณีศึกษาที่เกิดเหตุจากการประเมินความรุนแรงของอันตรายผิดพลาด
กรณีศึกษา การประเมินอันตรายจาก thermal runaway
ในถังปฏิกิริยาขนาด 2,000 กิโลกรัม ผลิตสาร intermediate (melt) ซึ่งต้องมีการให้ความร้อนที่อุณหภูมิ 90°C ซึ่งหลังจบ batch จะถูกส่งไปยังหน่วยผลิตถัดไป ด้วยข้อจำกัดในการทำงานทำให้ต้องเก็บสารไว้ในถังเป็นเวลา 3 วัน จึงทำการประเมินอันตรายก่อนทำการเก็บสารไว้ในถัง ด้วยข้อมูลดังนี้
– สาร intermediate จะเกิดการสลายตัว (decomposition) ด้วยอัตรา 1% ต่อวัน ที่อุณหภูมิ 90°C
– ในการสลายตัวจะมีการคายความร้อน 800 kJ/kg
– ปฏิกิริยาสลายตัวของสาร intermediate ทั้งหมดจะเกิดได้ที่อุณหภูมิ 200°C
– สารมีค่าความจุความร้อนจำเพาะ (specific heat capacity) ที่ 2 kJ/(kg-K)
– ถังเก็บไม่มีการกวนผสมของสาร (unstirred vessel)
ผลการประเมินอันตรายที่ผิดพลาด
ในการประเมินอันตรายคิดว่าสภาวะการเก็บเป็นแบบอุณหภูมิคงที่ (Isothermal) จากการรักษาอุณหภูมิด้วย steam jacket
สารจะสลายตัวที่อัตรา 1% ต่อวัน ดังนั้นหากทิ้งไว้ 3 วัน สารจะสลายตัว 3% และคายพลังงาน 800 [kJ/kg] x 3% = 24 [kJ/kg] ความร้อนที่คายออกมาจะถูกดูดซับโดยสารที่เหลือในถัง
เมื่อสารมีค่าความจุความร้อนจำเพาะ ที่ 2 kJ/(kg-K) ทำให้ถังจะมีอุณหภูมิสูงขึ้นเท่ากับ 24 [kJ/kg] / 2 [kJ/(kg-K)] = 12 K
ดังนั้นอุณหภูมิสารในถังน่าจะเพิ่มขึ้นจาก 90°C เป็น 102°C ซึ่งทาง Operation บอกว่ายอมรับได้ จึงทำการเก็บสารในสภาวะที่ทำการศึกษา แต่พบว่าเมื่อเข้าสู่วันที่ 3 เกิดการระเบิดที่รุนแรงในถัง เมื่อหาสาเหตุจึงพบว่าการประเมินอันตรายนั้นมีความผิดพลาด เนื่องจากในการเก็บสารไม่มีการกวนผสมทำให้อุณหภูมิในถังไม่เท่ากัน อัตราการสลายตัวของสารจึงไม่ใช่ค่าคงที่ แต่ต้องเพิ่มขึ้นตามอุณหภูมิที่สูงขึ้น
ผลการประเมินอันตรายที่ได้รับการแก้ไข
อัตราการคายความร้อนจากการสลายตัวของสารที่ 1% ต่อวันจะเท่ากับ 800,000 [J/kg] x 1% / (24 x 3600 [s]) = 0.1 J/(s-kg)
การประเมินสภาวะในการเก็บสาร พบว่าถังที่ไม่มีการปั่นกวน ทำให้อุณหภูมิของสารด้านในไม่มีการแลกเปลี่ยนความร้อนได้อย่างเหมาะสม ทำให้มีสภาวะใกล้เคียง Adiabatic condition (worst-case scenario) และอัตราการเพิ่มของอุณหภูมิในสภาวะ adiabatic สามารถคำนวณได้จาก
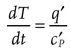
ดังนั้นอัตราการเพิ่มของอุณหภูมิเท่ากับ 0.1 [W/kg] / 2000 [J/(kg-K)] = 5×10-5 [K/s] = 0.2[°C/h]
เมื่อใข้ Van’t Hoff rule (อัตราเร็วในการเกิดปฏิกิริยาจะเพิ่มขึ้น 2 เท่าทุกๆอุณหภูมิที่เพิ่มขึ้น 10°C) ในการประมาณจะพบว่าอัตราเร็วในการเพิ่มอุณหภูมิที่ 100°C จะอยู่ที่ 0.4[°C/h] ดังนั้นหากเราใช้ค่าเฉลี่ยที่ 0.3[°C/h] คำนวณระยะเวลาในการเพิ่มอุณหภูมิจาก 90°C เป็น 100°C พบว่าต้องใช้เวลาประมาณ 32 ชั่วโมง
แต่อัตราเร็วก็จะเพิ่มขึ้นเรื่อยๆ โดยการเพิ่มจาก 100°C ไปที่ 110°C จะใช้เวลา 16 ชั่วโมง หากเป็นเช่นนี้ไปเรื่อยๆ อุณหภูมิจะเร่งจนถึงจุดที่เกิดการสลายตัวของสารทั้งถังและเกิดระเบิดได้ในเวลา 64 ชั่วโมง ซึ่งใกล้เคียงกับเวลาในการเกิดระเบิดในเหตุการณ์จริงซึ่งเกิดในวันที่ 3 หลังการเก็บสาร
เอกสารอ้างอิง
[1] https://www.maritime-executive.com/article/maib-overheated-cargo-caused-stolt-groenland-explosion
[2] Lin Zhao et al. Probing into Styrene Polymerization Runaway Hazards: Effects of the Monomer Mass Fraction. ACS Omega 2019, 4, 8136-8145.
[3] https://www.polymerdatabase.com/polymer%20chemistry/Polystyrene.html
[4] Thermal Safety of Chemical Processes: Risk Assessment and Process Design. Francis Stoessel. Wiley-VCH. 2008.



